軌域構造
軌域構造
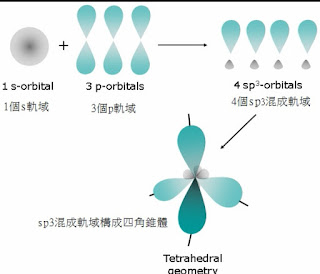
量子力學的內容雖然超過現階段的課程範圍,但是某些結論卻值得做定性的說明,對於瞭解詳細的原子結構有莫大的幫助。首先量子力學發現原子核外的電子,並不是單純的繞著原子核做圓周運動,像行星繞太陽一樣有固定的軌道 (orbit) ,而是無法預測電子的運動軌跡,只能知道電子在空間中某點出現的機率有多大。 角動量量子數(l ):此量子數可用來區別,主量子數(n)相同而形狀不同的軌域。 例如在M殼層的電子(n=3),可能的l 值為0,1或2,電子可能存在三種不同形狀的軌域之一。n值相同而l 值不同的軌域,分別稱其屬於不同的副殼層(subshell),不同的副殼層通常使用小寫的英文字母來標示例如 字母 s p d f g … 根據量子力學的描述,原子核外的電子有多種不同的存在方式,可以分別用四種量子數來區別,對於每一 n 值會有 n2 個不同的軌域。
原子的電子不會擁有四個相同的量子數,這個原則稱為庖利不相容原理 (Pauli exclusion principle) 。另外當電子填入各軌域時,必須按照構築法則 (Building-up principle) ,也就是電子由能量較低的軌域開始填起。
量子力學的內容雖然超過現階段的課程範圍,但是某些結論卻值得做定性的說明,對於瞭解詳細的原子結構有莫大的幫助。首先量子力學發現原子核外的電子,並不是單純的繞著原子核做圓周運動,像行星繞太陽一樣有固定的軌道 (orbit) ,而是無法預測電子的運動軌跡,只能知道電子在空間中某點出現的機率有多大。 角動量量子數(l ):此量子數可用來區別,主量子數(n)相同而形狀不同的軌域。 例如在M殼層的電子(n=3),可能的l 值為0,1或2,電子可能存在三種不同形狀的軌域之一。n值相同而l 值不同的軌域,分別稱其屬於不同的副殼層(subshell),不同的副殼層通常使用小寫的英文字母來標示例如 字母 s p d f g … 根據量子力學的描述,原子核外的電子有多種不同的存在方式,可以分別用四種量子數來區別,對於每一 n 值會有 n2 個不同的軌域。
原子的電子不會擁有四個相同的量子數,這個原則稱為庖利不相容原理 (Pauli exclusion principle) 。另外當電子填入各軌域時,必須按照構築法則 (Building-up principle) ,也就是電子由能量較低的軌域開始填起。







留言